- {REGIONS}
 8 (800)-222-56-04
8 (800)-222-56-04
(бесплатный звонок по России)
г. Екатеринбург,
ул.Первомайская 77, офис 307
+7 (343) 271-51-50, 372-50-16
 Мы на OZON!
Мы на OZON!
Дисульфид молибдена для физ.лиц
Статьи о молибдене
 Физические и химические свойства Молибдена
Молибден был известен древним грекам, как минерал свинца-галенит, который они назвали "молибденой", а чистый свинец "молибдосом".Однако по внешнему виду на галенит очень похожь графит и еще один минерал-тот самый, который называется теперь молибденитом,т.е сульфид Молибдена МоS2. Вплоть до конца 18 века молибденит не умели отличать от графита, и подобно ему, применяли его для карандашей.Молибден относится к шестой группе периодической системы и входит в подгруппу хрома.Находясь в пятом периоде, т.е. во втором большом периоде молибден имеет следующее расположение электронов: 2,8,18,13,1.В следствие такого расположения электронов молибден обладает переменной валентностью. В компактном состоянии чистый молибден представляет собой серебристо-белый металл, ковкий и довольно твердый. Плотность компактного молибдена 10,2 г/см3. Порошкообразный металлический молибден имеет темно-серый цвет.
Основные характеристики молибдена:
Упругость пара молибдена характеризуются следующими цифрами:
Компактный молибден на воздухе при обыкновенной температуре не окисляется; при нагревании свыше 600 °C металл окисляется с образованием трехокиси. По отношению к кислотам молибден менее устойчив, чем другие тугоплавкие металлы: он медленно растворяется в соляной кислоте при температуре 110 °C. Легко растворяется в царской водке, в смеси плавиковой и азотной кислот, а также в смеси азотной и серной кислот. Холодные растворы щелочей не действуют на молибден.
При растворении трехокиси молибдена в растворах щелочи или аммиака образуются соли молибденовой кислоты - молибдаты. Практическое значение имеют нормальные молибдаты и парамолибдаты, в частности парамолибдат аммония.Молибдат натрия Na2MoO4 получается при растворении трехокиси молибдена в растворе едкого натра: MoO3+2NaOH→Na2MoO4+H2O. Эта реакция широко используется при переработке молибденовых концентратов. Молибдат аммония (NH4)2MoO4 получается при взаимодействии концентрированного раствора аммиака с трехокисью молибдена. Нормальный молибдат аммония уже при комнатной температуре частично отщепляет аммиак; при температурах свыше 90°C начинает выделяться вода, а выше 150 происходит полное разложение соли.
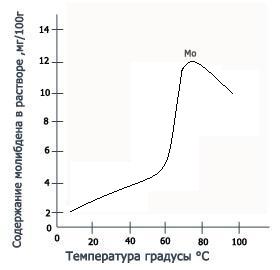 Молибдат кальция представляет собой белое кристаллическое вещество, практически нерастворимое в воде.Зависимость растворимости молибдата кальция от температуры показана на графике слева. Полученные данные показывают, что растворимость соли достигает максимума при температуре 80°C, состовляя при этом всего 10,9 мг молибденав 100г раствора.Реакция образования молибдата кальция используется при переработке молибденсодержащих щелоков. В виде молибдатов кальция и свинца молибден встречается в природе. Молибдат кальция представляет собой белое кристаллическое вещество, практически нерастворимое в воде.Зависимость растворимости молибдата кальция от температуры показана на графике слева. Полученные данные показывают, что растворимость соли достигает максимума при температуре 80°C, состовляя при этом всего 10,9 мг молибденав 100г раствора.Реакция образования молибдата кальция используется при переработке молибденсодержащих щелоков. В виде молибдатов кальция и свинца молибден встречается в природе.
В настоящее время молибден, подобно вольфраму, и ванадию, приобрел исключительное значение при выплавке сталей специального назначения , сочетающих высокую вязкость и твердость,и во многих других областях народного хозяйства.
Шестивалентный молибден принадлежит к подгруппе мышьяка сероводородной группы элементов. Открытие молибдена по образованию перлов с бурой или фосфорной солью не имеет практической ценности. Другие методы обнаружения молибдена так называемым сухим путем также не получили признание. Открытие молибдена по окрашиванию пламени. Также молибден можно обнаружить по появлению характерного окрашивания при электролитическом восстановлении на платиновом катоде.
Соединения молибдена с кислородом.
Трехокись молибдена MoO3 - ангидрид молибденовой кислоты. Белое с зеленоватым оттенком вещество, при нагревании желтеющее и заметно возгоняющееся при температурах ниже температуры плавления. Температура молибденовой кислоты состовляет 795°C. Температура кипения 1151°C. Растворимость трехокиси молибдена в воде незначительна. При взаимодействии молибдена с водой образуется молибденовая кислота. Она же получается при действии кислот на растворы молибдатов. Как ангидрид молибдена, так и кислота обладает несколько амфотерным характером, хорошо растворяясь в растворах щелочей и аммиака с образованием молибдатов( солей молибденовой кислоты).; они растворимы также в минеральных кислотах, чем отличаются от соответствующих соединений вольфрама. Это различие в поведении молибденового и вольфрамового ангидрида и соответствующих кислот имеет большое практическое значение.
Соединения молибдена с галогенами.
Металлический молибден в виде порошка реагирует с фтором при комнатной температуре. С хлором молибден образует ряд хлоридов, состав которых зависит от температуры и других условий хлорирования. Например при хлорировании молибдена хлором или фосгеном при 600 °C образуется молибденхлор третьей степени , при более низких температурах молибденхлор пятой степени. Последний молибденхлор образует изоморфные черные кристаллы с температурой плавления 194 °C и кипения 268 °C. Хлорид шестивалентного молибдена по - видимому, не существует. Многочисленными работами по хлорированию молибдена установлено, что между различными хлоридами молибдена, получающимися в процессе хлорирования, устанавливается определенное равновесие, причем при повышенных температурах преобладают бедные хлором и менее летучие соединения. Для температур плавления и кипения хлоридов молибдена в настоящее время установлены величины. Легкость возгонки оксихлорида молибдена в настоящее время используется для очистки трехокиси молибдена от вольфрама и других элементов: при 600-700 °C трехокись молибдена реагирует с хлоридом натрия, тогда как трехокись вольфрама при этом практически не вступает в реакцию с хлоридом натрия. Оксихлорид молибдена, возгоняясь, конденсируется в виде желтоватого вещества. В солянокислых растворах пятивалентный молибден также образует не одно, а три различных соединения, в зависимости от концентрирования соляной кислоты.
Комплексные соединения молибдена.
Молибден образует разнообразные комплексные соединения. Этим широко пользуются в аналитической химии для определения как самих металлов, так и элементов, вступающих с ними в комплексные группы. Одно из подобных соединений молибдена - фосфорно - молибденовокислый аммоний - широко применяется для весового определения фосфора. Известны еще более сложные гетерополисоединения молибдена, в которые входит не только ион молибдена, но и анион ванадиевой кислоты. Молибден образует также комплексные соединения с органическими кислотами - винной, лимонной, щавелевой.
Соединения молибдена с серой.
Для молибдена сернистые соединения и, в частности, сульфид четырехвалентного молибдена являются основной формой природного соединения. Природный дисульфид молибдена ( минерал молибденит) применяют в технике в качестве смазочного материала. Однако присутствие примесей, в частности кварца, снижает качество природного дисульфида молибдена, вследствие чего его получают синтетическим путем. Состав синтетического дисульфида близок к теоретическому, а свойства мало отличаются от свойств природного молибдена. Еще один сульфид молибдена можно получить при продолжительном пропускании сероводорода в горячий кислый раствор молибдена. При этом большое значение имеет кислотность раствора, так как сульфид образуется только в кислотной среде, а в нейтральных растворах получаются легко растворимые сульфосоли. Из кислых растворов молибден может быть осажден сероводородом в присутствии вольфрама, Этот прием рекомендуется делать для отделения вольфрама от молибдена в количественном анализе.
Применение молибдена
Молибден, который является одним из самых перспективных тугоплавких металлов для любой отрасли промышленности, еще и уникальный. В связи с развитием таких отраслей, как машиностроение и химическая промышленность возникает огромная потребность в молибдене и его сплавах. Молибден и его сплавы стали применять в авиастроении в середине 20 века. Данной отрасли потребовался очень легкий металл, с помощью которого стало возможно производить детали для корпуса самолета. Многим известно, что в авиации на протяжении долгого времени использовалась хромванадиевая сталь. Хромванадиевая сталь абсолютно не выдерживала нагрузок и пониженной температуры на больших высотах. Проблему раз и навсегда решили с помощью замены хромванадиевой стали на хроммолибденодвую. Подробнее прочитать про применение молибдена.
Купить молибден
В компании ТК Урал-Металл вы всегда можете приобрести продукцию из молибдена по самым низким ценам на отечественном рынке. Продукция выпускаемая на современном иностранном оборудовании известных марок, с учетом соблюдения международных сертификатов качества ISO, отечественных ГОСТА и ТУ, самая конкурентоспособная во всем Уральском регионе. На сайте компании вы всегда можете заказать: молибденовый пруток, молибденовую проволоку, молибденовый экран, молибденовую фольгу, прокат из молибдена и многое другое. Все ваши заказы мы принимаем и обрабатываем точно в срок. В нашей компании вы всегда можете приобрести молибден и его сплавы следующих марок: МЧВП, МЧ, М-МП99, ОЧМ, МРН и 95, МВ20, МВ50, МВ30, МР47ВП, МР47 и МД-7,5.
|
05.06.2018
Молибденовый порошок
05.06.2018
Молибденовая проволока
05.06.2018
Молибденовые сплавы
05.06.2018
Молибденовый штабик
05.06.2018
Сварка молибдена
05.06.2018
Применение молибдена
05.06.2018
Минералы и руды
05.06.2018
Технология получения молибдена
05.06.2018
Цена на продукцию из молибдена
05.06.2018




